大家晚上好,今天跟大家分享一篇三个月前发表在Journal of Experimental&Clinical Cancer Research的一区12分的文章《Deciphering the tumor immune microenvironment: single-cell and spatial transcriptomic insights into cervical cancer fibroblasts》。该研究通过单细胞和空间转录组学技术系统解析了宫颈癌中成纤维细胞的异质性,鉴定出6个成纤维细胞亚型,重点揭示了C0 MYH11+成纤维细胞亚群通过MDK-SDC1通路与肿瘤细胞互作,促进肿瘤进展,并基于该亚群构建了预后预测模型。

研究主要结果
宫颈癌成纤维细胞亚型全景
对选定数据集的所有细胞进行批次校正后,共获得69,494个高质量细胞。基于已知标志基因,将这些细胞分类为9种细胞类型,包括内皮细胞(ECs)、成纤维细胞、上皮细胞(EPCs)、平滑肌细胞(SMCs)、B-浆细胞、肥大细胞、中性粒细胞、骨髓细胞和T-NK细胞。需要注意的是,在细胞类型注释之前,通过基于inferCNV结果选择上皮细胞并突出显示高CNV评分的细胞来识别肿瘤细胞(补充图1A)。与其他细胞类型相比,EPCs表现出显著更高的G2/M和S评分。EPCs、成纤维细胞、ECs、骨髓细胞和SMCs具有更高的nCount RNA和nFeature RNA值(图2A)。

根据来源将细胞分为两组:肿瘤组(Neoplasm group)和肿瘤邻近正常组织组(Normal tissue adjacent to neoplasm group)。UMAP图显示,EPCs、中性粒细胞、骨髓细胞和T-NK细胞主要集中在肿瘤组,而ECs、成纤维细胞和SMCs主要位于肿瘤邻近正常组织组。柱状图表明,EPCs在肿瘤组中占比最大,而成纤维细胞是肿瘤邻近正常组织组的主要细胞类型。此外,成纤维细胞主要处于G1期,而EPCs主要处于G2/M和S期(图2B)。关于差异基因表达,成纤维细胞的前5个标志基因是PTGDS、DCN、COL1A1、COL1A2和COL3A1。在肿瘤邻近正常组织组中表达较高的基因包括这些标志物以及TAGLN和C11orf96(图2C)。
对每种细胞类型差异表达基因的GO-BP分析显示,成纤维细胞主要富集在外部包裹结构组织、细胞外结构组织和细胞外基质组织等过程中(图2D)。进一步分析表明,成纤维细胞中上调的基因主要与IL-17信号通路、军团菌病、脂质代谢、动脉粥样硬化、TNF信号通路以及抗原加工和呈递等通路相关。相反,下调的基因与肌细胞骨架、局部粘附、血管平滑肌收缩和癌症中的蛋白聚糖相关(图2E)。GSEA分析强调了成纤维细胞的两条重要通路:跨膜受体蛋白丝氨酸/苏氨酸激酶信号通路和胶原纤维组织(图2F)。富集网络图进一步揭示,所有成纤维细胞亚型的基因集在细胞表面受体信号通路和丝氨酸水解酶活性中富集最多(图2G)。
重新进行批次校正后, 将来自肿瘤组和肿瘤邻近正常组织组的15,843个成纤维细胞分类为六个不同的细胞簇。在注释成纤维细胞亚型之前, 观察了每个亚型的CNV(拷贝数变异)模式(补充图1B)。然后根据特异性标志基因表达命名亚型(补充图2A),并使用空间转录组学确认这六个标志基因的表达(补充图2B)。六个亚型分别为:C0 MYH11+成纤维细胞、C1 CCN5+成纤维细胞、C2 CXCL14+成纤维细胞、C3 LUM+成纤维细胞、C4 GGT5+成纤维细胞和C5 ABCA8+成纤维细胞(图2H)。除C2亚型有部分细胞来自肿瘤组外,其他亚型的大多数细胞源自肿瘤邻近正常组织组。所有成纤维细胞亚型的大多数细胞都处于G1期(图2I)。在这些亚型中,C0 MYH11+成纤维细胞在三个肿瘤邻近正常组织组样本中占比最大(图2J)。 还使用空间转录组学验证了所选宫颈癌组织切片点中所有成纤维细胞亚型的存在(图2K,补充图7A)。
接下来, 使用UMAP图可视化了亚型间nFeature RNA、CNV评分和nCount RNA的差异。值得注意的是,C0亚型表现出较高的CNV评分(图2L)。对C0亚型的反卷积分析显示,来自肿瘤邻近正常组织组的细胞丰度高于来自肿瘤组的细胞。除EPCs外,C0亚型包含第二高比例的细胞,这与 的观察一致。在GSE7803、GSE52903和内部bulk RNA-seq数据中,MYH11在邻近正常组织中的表达高于肿瘤组织,这与单细胞分析一致(补充图2C-E,补充图7B)。空间转录组学进一步表明可能存在各种CNV标签,CNV标签ST特征图显示标签1-8以及正常标签(图2M)。这些CNV标签与不同的CNV评分相关(补充图2F)。
然后 检查了所有成纤维细胞亚型的差异基因表达(图2N),并对每个亚型的差异表达基因进行了富集分析。GO-BP分析显示,C0亚型主要富集在与mRNA加工调控和细胞质翻译相关的过程中(图2O)。C0亚型的词云图突出显示了肌肉、心脏、解聚、分化和生长等关键术语(图2P)。基于空间转录组学, 推断了C0亚型在宫颈癌组织切片中的可能位置,如图2Q所示。此外,对肿瘤组和肿瘤邻近正常组织组上调基因的GO-BP分析表明,在肿瘤邻近正常组织组中上调的基因主要富集在与冠状病毒病(COVID-19)、脂质代谢和动脉粥样硬化、IL-17信号、军团菌病和TNF信号相关的通路中(图2R)。最后,对C0亚型的GSEA分析显示在肌肉收缩、骨骼肌器官发育和肌肉系统过程中显著富集(图2S)。
成纤维细胞亚型的干性、代谢和CAF特征异质性
为更好地理解成纤维细胞亚型之间的各种差异以及关键亚型C0的特异性特征, 进行了更全面的评分和可视化分析。首先, 使用UMAP显示亚型间细胞干性的差异,空间转录组学分析确认了细胞干性AUC值的最大潜力。箱线图比较了亚型间的干性水平,显示C2亚型表现出最高的干性,其次是C1、C4和C0亚型,而C3的干性最低(图3A)。接下来,气泡图可视化了亚型间以及两个样本组间干性基因的表达差异。C0亚型中高表达的干性基因包括CTNNB1、CD44和KDM5B,而在肿瘤邻近正常组织组中,CTNNB1、CD44和MYC高表达(图3B)。然后 使用UMAP可视化了C0亚型中高表达的干性基因(KDM5B、CTNNB1和CD44),与在C0亚型中几乎不存在的干性基因CD34形成对比(图3C)。此外,小提琴图用于可视化比较两个样本组间干性基因的表达水平(图3D)。
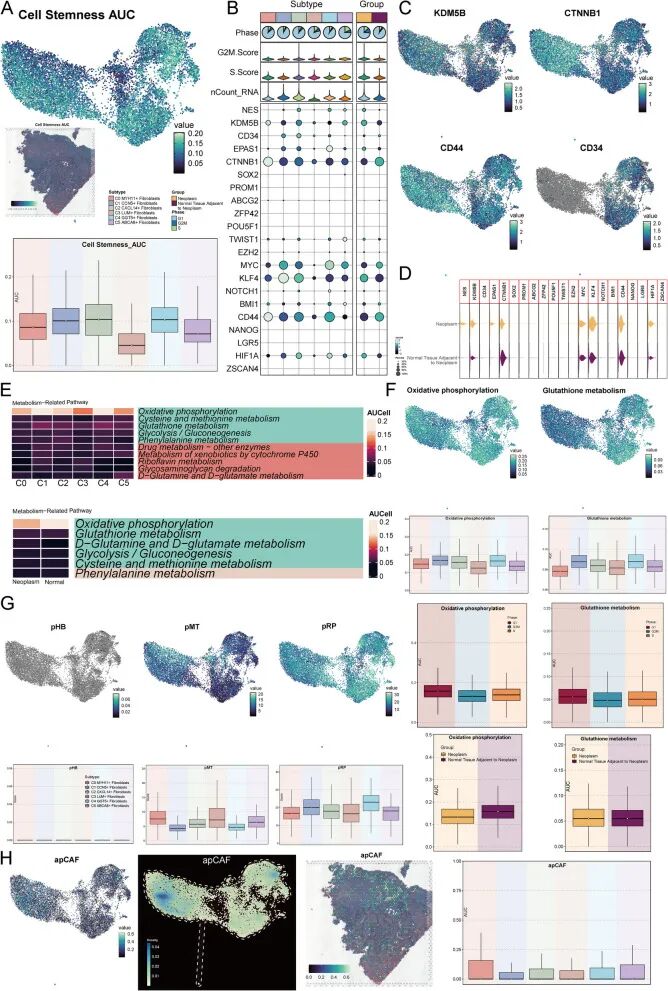
然后 使用热图显示了所有成纤维细胞亚型和两个样本组的显著代谢通路(图3E)。C0亚型和肿瘤邻近正常组织组都显示氧化磷酸化是最突出的代谢通路,其次是谷胱甘肽代谢。专门可视化了这两条通路。两条代谢通路中的细胞大多处于G1期,但氧化磷酸化在肿瘤邻近正常组织组中更突出,而谷胱甘肽代谢则不太明显(图3F)。 还对成纤维细胞亚型的pHB、pMT和pRP进行了评分,发现与其他亚型相比,C0具有最高的pMT评分,而其pRP评分最低。pHB在所有亚型中几乎为零(图3G)。
最后,为评估该数据集中成纤维细胞亚型的CAF(癌相关成纤维细胞)特征, 对所有亚型进行了六个相关CAF特征的评分。气泡图显示了亚型间CAF相关评分的差异(补充图3A)。 发现,与其他亚型相比,C0亚型的apCAF评分差异最显著。然后 可视化了apCAF评分,确实在C0亚型中更高,密度更强。小提琴图也证实了这一观察结果。此外,空间转录组学验证了apCAF在宫颈癌组织切片中的最大潜力(图3H)。其他五个CAF相关特征在亚型间的评分和密度差异也通过UMAP图显示(补充图3B、C),并通过空间转录组学进一步验证(补充图3D)。箱线图直观比较了亚型间CAF相关评分的水平(补充图3E)。
C0亚型在拟时序轨迹中的显著特征
首先,CytoTRACE分析揭示了不同成纤维细胞亚型的分化水平,C4亚型显示最低分化,C0亚型显示最高分化(图4A、B)。与CytoTRACE分析正相关的基因包括VIM、FTL、S100A6、LGALS3、TMSB10、CD63、S100A4、CFD、CST3和RPS23(图4C)。接下来, 在UMAP图上显示了亚型间拟时序顺序的分布(图4D),并构建了一个从左到右时间进展的拟时序轨迹,具有两个分支点。然后 将每个成纤维细胞亚型映射到这个轨迹上,大多数C0亚型位于右侧分支(图4E)。热图显示了差异基因随拟时序进展的表达差异(图4F)。
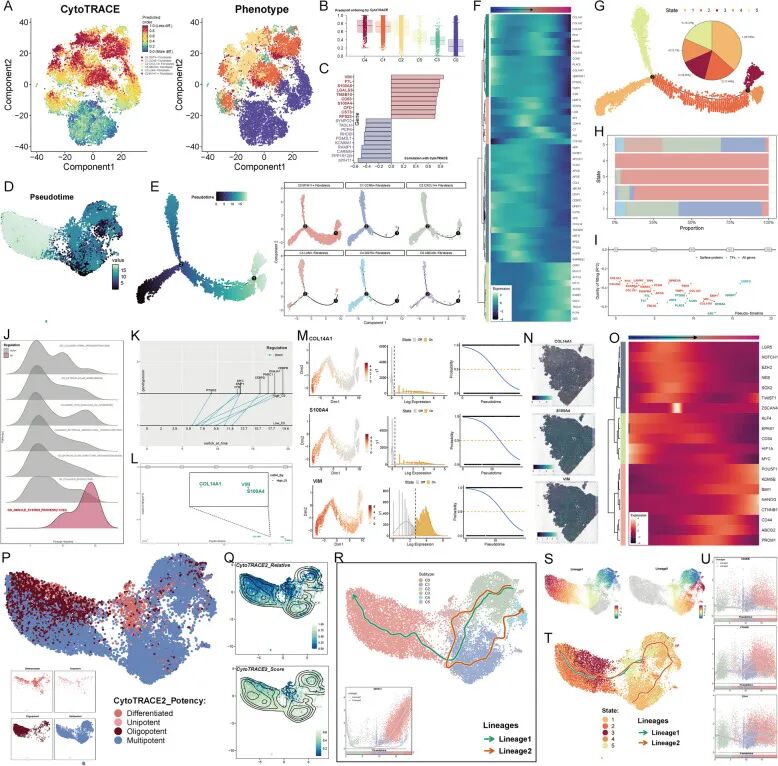
为更好地定义拟时序轨迹上的位置,根据两个分支点将整个轨迹分为五个部分,并将它们命名为五个状态。饼图显示了每个状态在整个拟时序轨迹中的比例,state1占最大比例为36.58%(图4G)。堆叠柱状图显示了每个成纤维细胞亚型在每个状态中的比例,C0亚型在状态2、3和4中占主导地位(图4H)。基于Monocle,整合了GeneSwitches,首先展示了轨迹中的所有表面蛋白、转录因子(TFs)和基因(图4I)。由于将轨迹分为两条主要路径,一条由state1和5组成,另一条由state1-4组成,将包含更多C0亚型细胞的分支命名为High C0,而另一条分支命名为Low C0。然后对High C0轨迹上的上调和下调基因进行了GO-BP分析,结果如图4J所示。上调基因主要富集在GO_MUSCLE_SYSTEM_PROCESS通路中。
接下来,检查了High C0和Low C0轨迹之间的异质性。两条轨迹间的共同基因包括PTGDS、CFD、EMP1、MYC、CEBPD、PNRC1、DNAJA1和CEBPB(图4K)。High C0轨迹中特异性表达的基因包括CST3、COL14A1、VIM和S100A4(图4L)。其中,CST3早期表达,而其他三个基因后期表达。因此,选择COL14A1、S100A4和VIM来可视化它们沿轨迹的表达水平(图4M)。空间转录组学确认了COL14A1、S100A4和VIM的最佳可能存在(图4N)。
此外,特别关注了细胞干性和干性基因表达沿拟时序的景观。首先,热图显示了干性基因随拟时序进展的时间表达差异(图4O)。还使用CytoTRACE2揭示不同成纤维细胞亚型干细胞的功能差异,UMAP图显示C0亚型主要由多能和寡能干细胞组成(图4P)。为验证CytoTRACE2的准确性,在UMAP图上展示了不同亚型CytoTRACE2的相对密度和评分密度(图4Q)。
最后,使用Slingshot构建了两条轨迹,Lineage1和Lineage2。在Lineage1中,发育序列为C2-C3-C1-C0,C0亚型的命名基因MYH11在两条轨迹的中晚期高表达(图4R)。随后的UMAP图显示了两条轨迹经过的成纤维细胞亚型范围(图4S)。此外,热图显示了两条轨迹的差异基因表达,随后进行了富集分析。结果显示,Lineage1晚期高表达的基因包括CHRDL2、TAGLN、TPM2、CNN1、ACTC1和TENM2。这些差异基因主要富集在肌肉、肾脏、组装、丝状伪足、肌原纤维和心脏等术语中(补充图4A)。接下来,基于UMAP图上的不同状态构建了两条轨迹,巧合的是,这两条轨迹大部分重叠,它们的终点分别在C0亚型所在的state2和state4(图4T)。最后,干性基因KDM5B在Lineage1晚期高表达,CTNNB1在Lineage1晚期也显著上调,CD44在Lineage1和Lineage2的中晚期高表达(图4U)。
C0亚型通过MDK-SDC1通路与肿瘤细胞互作
为了解C0亚型与肿瘤细胞之间的互作,首先使用环形图显示了所有成纤维细胞亚型与其他细胞之间的互作(图5A)。无论在强度还是数量上,成纤维细胞亚型与各种细胞之间都存在丰富的互作。接下来,特别展示了靶细胞的传入通讯模式和分泌细胞的传出通讯模式(图5B)。显示了肿瘤组和肿瘤邻近正常组织组之间各种信号通路的差异表达强度(图5C)。值得注意的是,TGFb、MDK、PARs、ANNEXIN、BAFF、PERIOSTIN、APRIL、CD37、NRG、TRAIL、IFN-II、OSM等通路在肿瘤组中的表达显著更高(图5C)。无论在表达强度还是数量上,肿瘤组总是显示高于肿瘤邻近正常组织组的值。
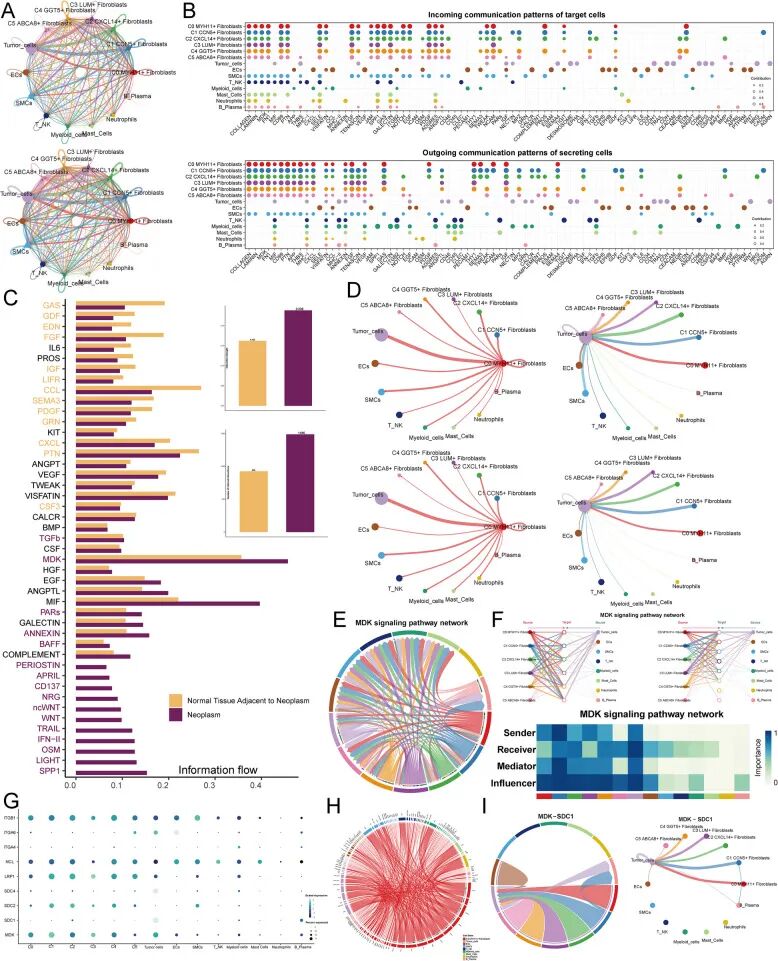
关键感兴趣亚群与宫颈癌肿瘤细胞之间的互作至关重要。为可视化这一点,使用环形图显示C0亚型与其他细胞类型之间的互作数量和强度(图5D)。结果清楚地显示,C0亚型与多种细胞互作,与肿瘤细胞的互作明显更强、更频繁。此外,另一个环形图展示了所有细胞类型与肿瘤细胞之间的互作,揭示成纤维细胞亚型与肿瘤细胞具有显著的互作强度和频率。接下来,可视化了两组中参与C0亚型-肿瘤细胞互作的受体-配体对(补充图4B)。MDK相关通路特别突出,促使使用和弦图展示该通路中的所有互作(图5E)。还绘制了显示MDK信号通路中所有细胞自分泌和旁分泌互作的层次图,从而了解到C0亚型是重要的信号转导传递者,肿瘤细胞是其主要受体(图5F)。MDK信号通路网络的中心性评分分析表明,C0亚型主要作为信号的发送者、调节者和影响者(图5F)。
为识别其他关键受体蛋白,分别使用气泡图和和弦图可视化了C0亚型与其他细胞类型之间的互作(图5G、H)。MDK-SDC1通路成为最重要的通路,因此可视化了该通路中的所有细胞互作。和弦图和环形图都强调MDK-SDC1通路是C0亚型与肿瘤细胞之间串扰的关键途径(图5I)。此外,空间转录组学确认了SDC1作为受体蛋白的突出存在(补充图4C)。
转录因子调控网络景观
为了解亚型间转录因子(TFs)的差异,尝试可视化它们的转录调控景观。首先,展示了显示每个亚型前5个TFs的热图,C0亚型的前5个TFs是CUX1、TEAD1、HOXA10、PBX1和FOSL2(图6A)。接下来,根据RSS对C0亚型的调控因子进行排名,并在UMAP图中用深绿色点突出显示它们。还根据RAS在UMAP上绘制了C0亚型的最高调控因子,它们的分布用深绿色点显示,与热图结果一致(图6B)。UMAP图显示,CUX1、TEAD1、HOXA10、PBX1和FOSL2在C0亚型中都表达更高(图6C),箱线图提供了直接比较(图6D)。空间转录组学验证了这5个TFs的可能存在(图6E)。
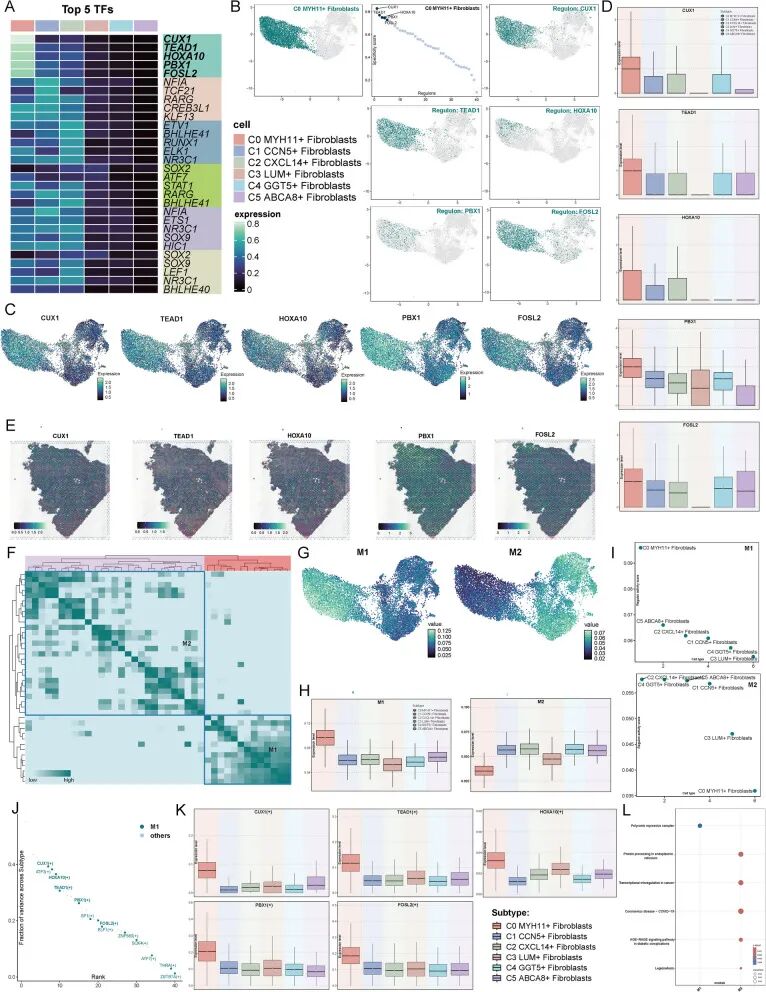
接下来,应用SCENIC识别规则和CSI矩阵来揭示成纤维细胞亚型的调控模块。基于AUCell评分,将调控模块分为两个主要组,M1和M2(图6F)。当在UMAP上可视化每个模块的平均活性评分时,观察到模块与不同成纤维细胞亚型之间的明显关联(图6G)。C0亚群的M1模块得分最高,而M2模块得分最低(图6H)。随后,对M1和M2中每个亚型的转录因子(TF)活性评分进行了排名。在M1中,C0亚型显示出比其他亚型显著更高的TF活性,而在M2中,C0的TF活性明显低于其他亚型(图6I)。还根据亚型间解释的方差对M1中的前5个TFs进行了排名,发现这些TFs排名最高(图6J)。亚型间这5个TFs表达水平的比较显示,所有这些TFs在C0亚型中都显著表达(图6K)。最后,对M1和M2中的差异表达基因和TFs进行了GO-BP分析。结果显示,M1主要富集在多梳抑制复合物通路中,而M2主要与内质网蛋白质加工、癌症转录失调、冠状病毒病(COVID-19)、糖尿病并发症中的AGE-RAGE信号通路和军团菌病等过程相关(图6L)。
基于C0亚型的宫颈癌预后预测模型
鉴于SDC1在宫颈癌中的关键作用,基于C0亚型开发了宫颈癌的预后模型。的分析确定了10个与患者预后显著相关的基因(图7A-D)。然后可视化了高MFRS组(MYH11+成纤维细胞风险评分)和低MFRS组之间的生存和基因表达差异(图7E、F)。结果表明,模型中包含的基因具有强大的预测能力(图7G、H)。此外,高SDC1表达组与低SDC1表达组相比显示出显著较低的总生存率(p=0.013)(图7I)。为进一步评估MFRS的独立预后价值,在TCGA数据库中对总生存期(OS)进行了多变量Cox分析(图7J)。创建了整合MFRS风险评分、年龄类别(高和低)、种族(美洲印第安人或阿拉斯加原住民、亚洲人、黑人或非裔美国人、白人)和肿瘤分级(G2、G3、GB、GX)的列线图,以预测训练队列中的1年、2年和3年OS(图7K)。
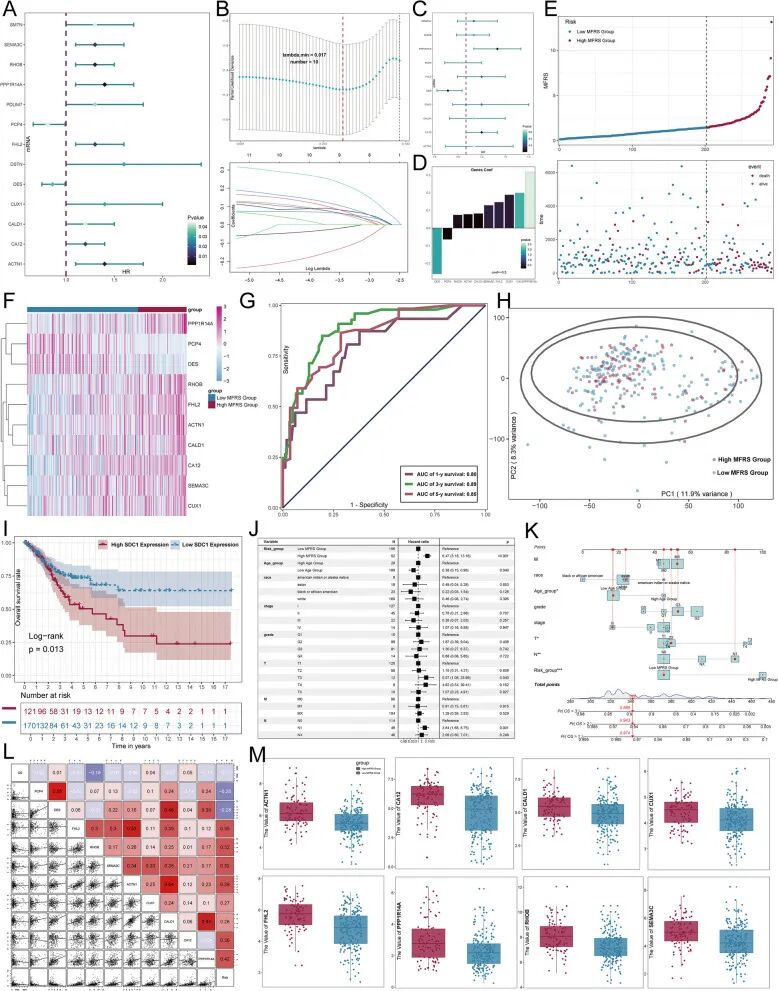
此外,使用散点图和热图评估并可视化了10个预后相关基因、OS和MFRS之间的相关性(图7L)。为进一步验证的发现,从10个风险基因中随机选择了8个基因,并比较了它们在高MFRS组和低MFRS组之间的表达水平。箱线图和散点图显示的结果表明,与低MFRS组相比,所有8个基因在高MFRS组中的表达水平都显著更高(图7M)。
免疫浸润分析
为研究高MFRS组和低MFRS组之间的异质性,对其肿瘤免疫微环境进行了广泛分析。最初,生成了热图以可视化两组中22种不同免疫细胞类型的分布(补充图5A)。箱线图显示,M0巨噬细胞、CD4记忆静息T细胞和CD8 T细胞的代表性较高。此外,与低MFRS组相比,高MFRS组显示出更丰富的活化肥大细胞、M0巨噬细胞和静息NK细胞(补充图5B)。相关性分析表明,初始B细胞与浆细胞之间,以及CD8 T细胞与活化CD4记忆T细胞之间存在强相关性(补充图5C)。此外,发现风险评分基因和MFRS组与活化肥大细胞、M0巨噬细胞、静息NK细胞、中性粒细胞、静息CD4记忆T细胞、γδT细胞和活化NK细胞呈正相关(补充图5D)。进一步利用CIBERSORT和Xcell算法估计两个MFRS组中免疫浸润的比例(补充图5E)。
接下来,比较了两组之间的StromalScore、ImmuneScore和ESTIMATEScore,发现低MFRS组的所有评分都更高(补充图5F)。肿瘤纯度在高MFRS组更高,但高龄组和低龄组之间的肿瘤纯度没有显著差异。与高MFRS组相比,低MFRS组的TIDE评分略高(补充图5G-I)。
此外,评估了训练队列中体细胞基因突变频率,并确定了突变率最高的前20个基因(补充图5J),其中TTN显示最频繁的突变。对10个预后相关基因的CNV分析显示频繁的增益和缺失,特别是PPP1R14A、DES和CALD1(补充图5K)。计算了两组的肿瘤突变负荷(TMB)值,并使用小提琴图可视化其分布。尽管两组之间的TMB值没有观察到显著差异,但低MFRS组更可能表现出高TMB(补充图5L)。此外,观察到TMB值与风险评分之间呈负相关(补充图5M),表明这些因素之间存在潜在关系。基于TMB中位值,将训练队列分为高TMB组和低TMB组,并按MFRS组进一步分层(补充图5N、O)。低TMB组生存率较低(补充图5N),与其他三组相比,高风险-低TMB组的生存率最低(补充图5O)。
肿瘤边界特征和关键基因的Kaplan-Meier生存曲线
首先,继续利用空间转录组学生成图8A所示的ST特征图,该图更清楚地描述了所选切片中肿瘤边界、恶性区域和正常组织的分布。此外,在比较两组时,高MFRS组的总生存率显著低于低MFRS组(p<0.0001)(图8B)。对MYH11、KDM5B、CTNNB1、CD44、CUX1、TEAD1、HOXA10、PBX1和FOSL2等关键基因进行了生存曲线分析。除MYH11外,所有基因在高表达组中的生存率都低于低表达组(补充图6A)。
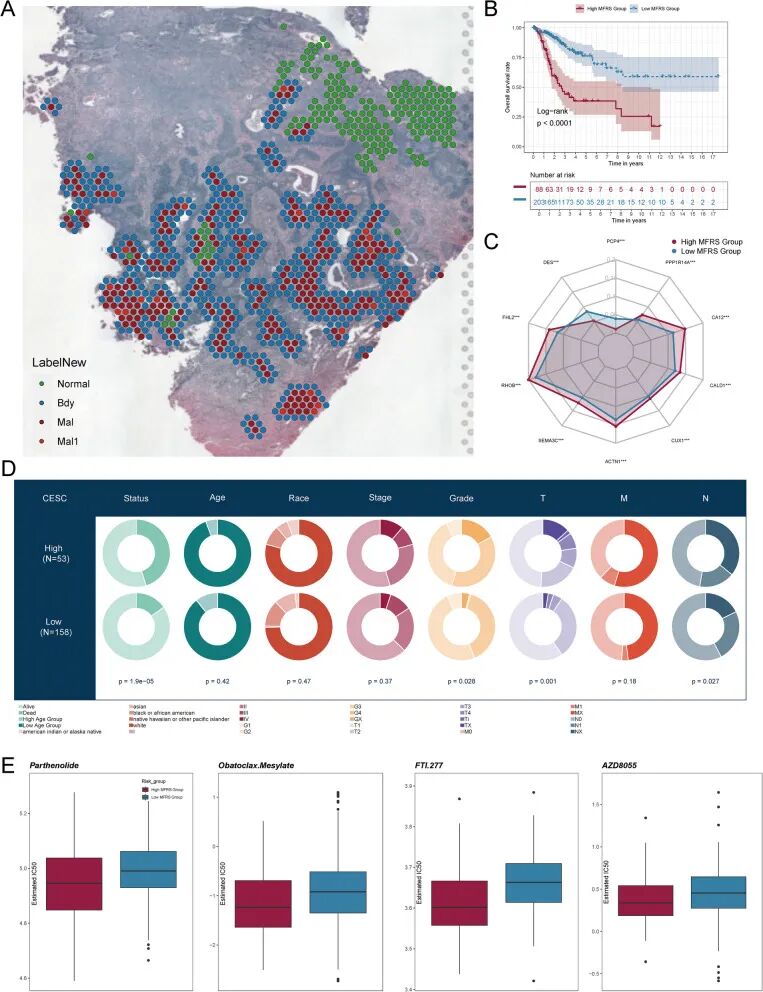
还可视化了10个预后基因的表达模式,与之前的观察类似,只有DES和PCP4在低MFRS组中相对于高MFRS组表现出更高的表达水平(图8C)。此外,分析了预后基因在各种状态类别(如年龄、种族、阶段和分级)中的分布(图8D)。最后,检查了高MFRS组和低MFRS组之间四种免疫相关药物(Parthenolide、Obatoclax Mesylate、FTI.277和AZD8055)的IC50值(图8E)。所有四种药物的IC50值在高MFRS组中都较低,而在低MFRS组中较高。
高MFRS组和低MFRS组之间的富集分析
为进一步探索高MFRS组和低MFRS组之间的功能差异,分析了两组之间的差异表达基因(DEGs),并检查了它们富集的通路。最初,确定了高MFRS组和低MFRS组之间的DEGs(图9A、B)。然后进行了GO-BP、GO-CC和KEGG通路分析(图9C-E)。在GO-BP分析中,通路主要富集在与消化、中间丝组织等相关的过程中。GO-CC分析显示富集在质膜的外在成分、刷状缘、肌动蛋白基细胞突起簇、连环蛋白复合物、中间丝细胞骨架和膜的外在成分中。KEGG通路分析突出显示了与成年型糖尿病、Ras信号、金黄色葡萄球菌感染、碳水化合物消化吸收和癌症转录失调相关的通路。

此外,进行了GSEA分析,显示上调基因主要富集在胶原分解过程、伤口愈合、表皮细胞扩散、内胚层形成和细胞外基质分解等过程中。相反,下调基因主要富集在钾离子稳态、杀死其他生物体细胞、轴丝组装等过程中(图9F)。
还将几个富集通路与构建的预后模型的风险评分相关联(图9G)。值得注意的是,PEDERSEN_TARGETS_OF_611CTF_ISOFORM_OF_ERBB2、REACTOME_CELL_EXTRACELLULAR_MATRIX_INTERACTIONS、BRUECKNER_TARGETS_OF_MIRLET7A3_DN和ELVIDGE_HYPOXIA_UP等术语与风险评分呈显著正相关,表明潜在的统计学意义。为进一步研究在高MFRS组和低MFRS组中富集的显著通路,使用雷达图,揭示了GOBP_BRANCHED_CHAIN_AMINO_ACID_TRANSPORT、GOBP_REGULATION_OF_VENTRICULAR_CARDIAC_MUSCLE_CELL_ACTION_POTENTIAL、GOBP_NEGATIVE_REGULATION_OF_CYCLIC_NUCLEOTIDE_PHOSPHODIESTERASE_ACTIVITY、GOBP_PROTEIN_LOCALIZATION_TO_PLASMA_MEMBRANE_RAFT、GOBP_INHIBITORY_SYNAPSE_ASSEMBLY和GOBP_NEGATIVE_REGULATION_OF_GLUTAMATE_SECRETION等术语在高MFRS组中显著富集(图9H)。
最后,为探索两组中的免疫细胞景观,发现活化树突状细胞、M0巨噬细胞、活化NK细胞和静息NK细胞在高MFRS组中更丰富(图9I)。
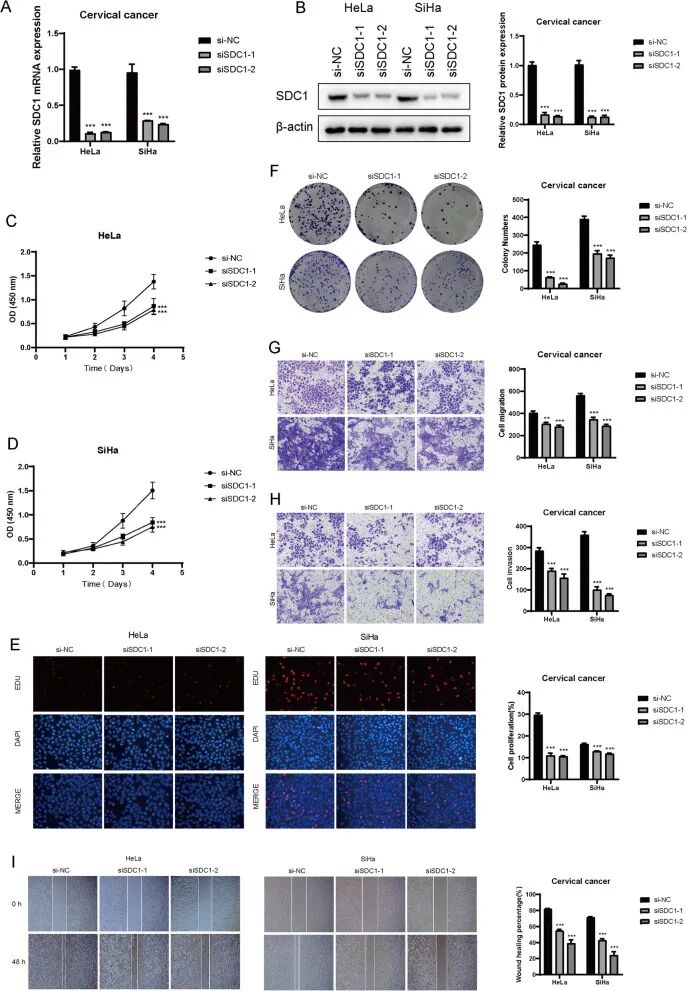
SDC1促进宫颈癌细胞的增殖、迁移和侵袭
为研究SDC1在宫颈癌中的具体作用,进行了体外实验。在两种宫颈癌细胞系HeLa和SiHa中敲低SDC1,观察到SDC1 mRNA的相对表达显著降低(图10A)。同样,敲低后SDC1蛋白表达也显著下调(图10B)。CCK-8检测显示,敲低SDC1导致HeLa和SiHa细胞的细胞活力显著下降(图10C、D)。EDU染色实验表明,敲低SDC1显著降低了宫颈癌细胞的增殖能力(图10E)。集落形成实验表明,SDC1敲低后形成的细胞集落数量显著低于对照组,进一步证实了增殖能力的降低(图10F)。最后,Transwell和伤口愈合实验均表明,SDC1表达降低显著削弱了宫颈癌细胞的迁移和侵袭能力(图10G-I)。
成纤维细胞异质性和空间分布的特征
为研究肿瘤微环境中成纤维细胞的异质性和空间组织,对来自肿瘤区(TZ)、交界区(JZ)和正常区(NZ)的福尔马林固定石蜡包埋(FFPE)人体组织样本,以及分离的正常成纤维细胞(NFs)和癌相关成纤维细胞(CAFs)进行了多重免疫组化(mIHC)。评估了一组成纤维细胞相关标志物,包括α-平滑肌肌动蛋白(α-SMA)、波形蛋白、钙调蛋白、纤连蛋白和肌球蛋白重链11(MYH11)。
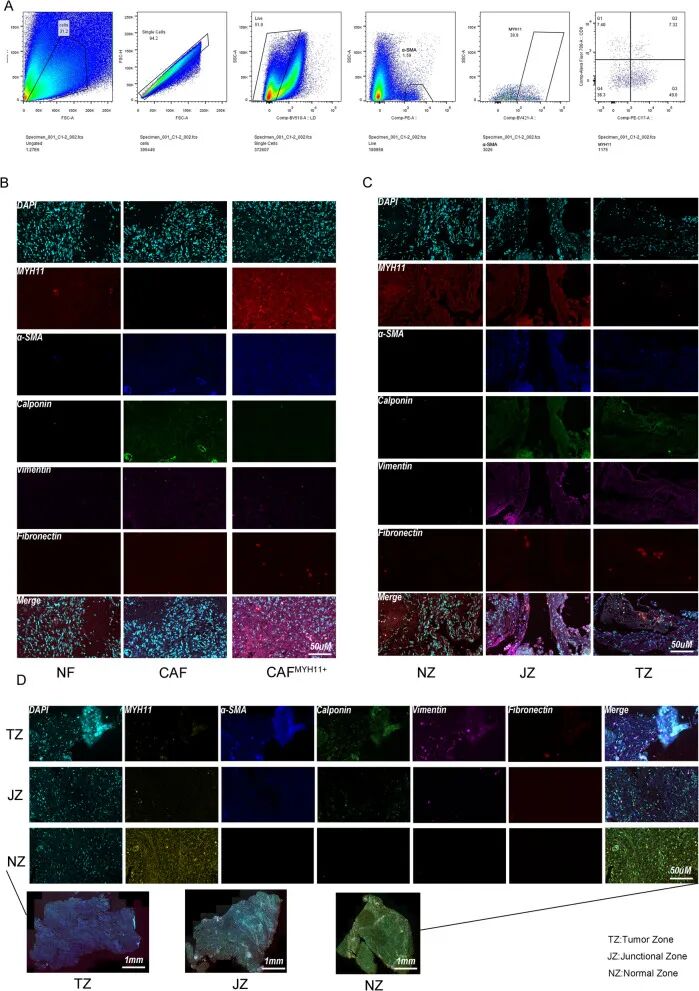
采用流式细胞术定义活的单个CD45⁻CD31⁻α-SMA⁺成纤维细胞群(图11A),使用MYH11进一步区分亚群。发现与CAFs相比,NFs中MYH11的表达显著更高。相反,CAFs表现出钙调蛋白、波形蛋白和纤连蛋白的高表达,而这些在NFs中表达最少或不表达(图11B)。
组织切片的空间分析显示,从NZ到TZ,成纤维细胞活化标志物表达呈进行性增加(图11C)。具体来说,α-SMA、钙调蛋白、波形蛋白和纤连蛋白在NZ中弱表达,在JZ中中度表达,在TZ中强共表达。相反,MYH11表现出相反的梯度,在NZ中强表达,在JZ中中等水平,在TZ中表达最少。这些发现表明沿NZ-JZ-TZ轴存在空间调控的成纤维细胞活化轨迹。
高倍和低倍mIHC图像(图11D)证实了α-SMA、钙调蛋白、波形蛋白和纤连蛋白主要在TZ中共定位,在JZ中观察到部分重叠,在NZ中表达最少。相反,MYH11主要在NZ中共定位,在JZ中表达降低,在TZ中信号可忽略不计。总的来说,这些数据揭示了空间上不同的成纤维细胞活化模式,强调了肿瘤微环境中的表型异质性和动态基质重塑。
C0 MYH11+ CAF通过可溶性SDC1促进肿瘤细胞增殖、迁移并抑制凋亡
为进一步阐明C0 MYH11+ CAF的功能特征,将分离的C0 MYH11+ CAF与高侵袭性和低侵袭性宫颈癌细胞共培养。实验程序如图12A所示,将成纤维细胞与肿瘤细胞共培养,随后收集培养上清液处理肿瘤细胞。为研究SDC1的作用,对C0 MYH11+ CAF中的SDC1基因进行了siRNA介导的沉默,导致SDC1蛋白表达显著降低,如图12B所示。接下来,评估了重组人SDC1蛋白的最佳浓度,以研究可溶性SDC1对肿瘤细胞的影响。如图12C所示,用200 ng/mL的SDC1处理导致肿瘤细胞增殖的最强促进,而500 ng/mL的浓度抑制了细胞增殖,可能是由于细胞毒性效应。
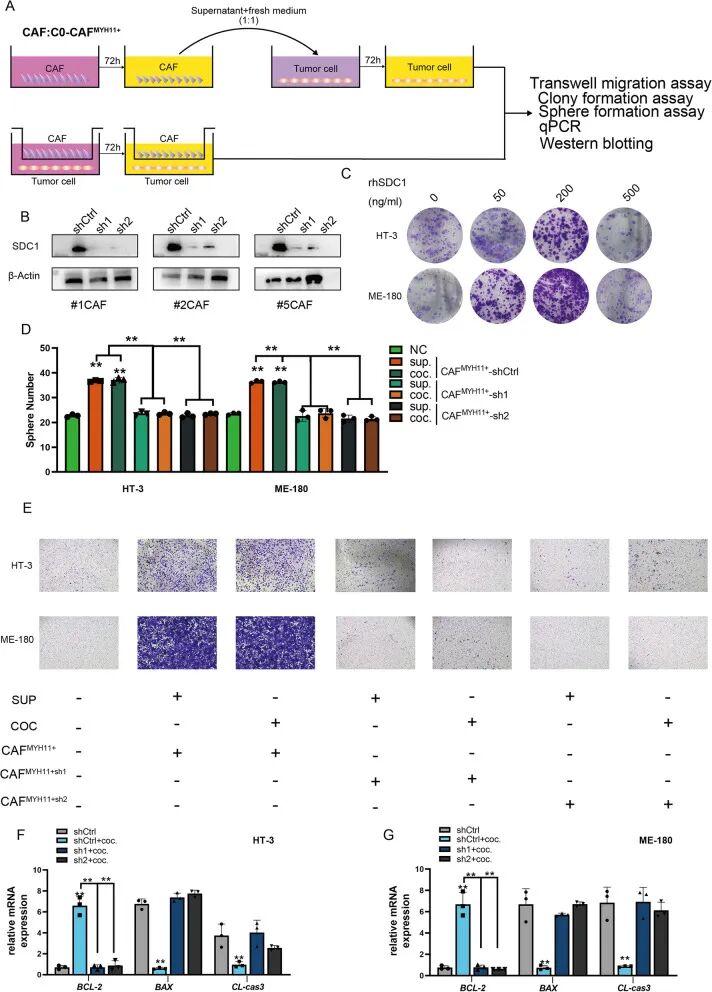
然后进行了球体形成实验来评估C0 MYH11+ CAF对肿瘤细胞干性的影响。如图12D所示,用C0 MYH11+ CAF培养上清液处理或与C0 MYH11+ CAF共培养的肿瘤细胞形成的球体显著更多,表明干性增强和恶性程度增加。进行了迁移实验,图12E的结果表明,暴露于C0 MYH11+ CAF或其培养上清液的肿瘤细胞迁移显著增加,表明侵袭能力增强。
此外,qRT-PCR分析显示,与C0 MYH11+ CAF共培养或用其培养上清液处理的肿瘤细胞显示抗凋亡基因mRNA显著上调,促凋亡基因mRNA下调,导致凋亡减少(图12F-G)。这些结果共同表明,C0 MYH11+ CAF通过可溶性SDC1的作用促进肿瘤细胞增殖、迁移和干性,同时抑制凋亡。
对这个思路感兴趣的老师可以联系。
![[一区 12分] 单细胞和空间转录组学揭示宫颈癌成纤维细胞](/media/blog/covers/cover_20251017.jpg)