大家晚上好,今天跟大家分享一篇发表在International Journal of Surgery 的单细胞联合转录组文章《Single-cell and bulk RNA-sequence identified fibroblasts signature and CD8 + T-cell - fibroblast subtype predicting prognosis and immune therapeutic response of bladder cancer, based on machine learning: bioinformatics multi-omics study》。该研究通过单细胞和bulk RNA测序技术鉴定了膀胱癌中54个成纤维细胞相关基因,利用10种机器学习算法筛选出3个核心基因(CRYAB、FN1、COL6A1)构建预后模型,并结合CD8+ T细胞活性创建了四种亚型(CD8+FH、CD8+FC、CD8-FH、CD8-FC)用于预测预后和免疫治疗反应。

Results
膀胱癌中成纤维细胞相关基因(FRG)的鉴定
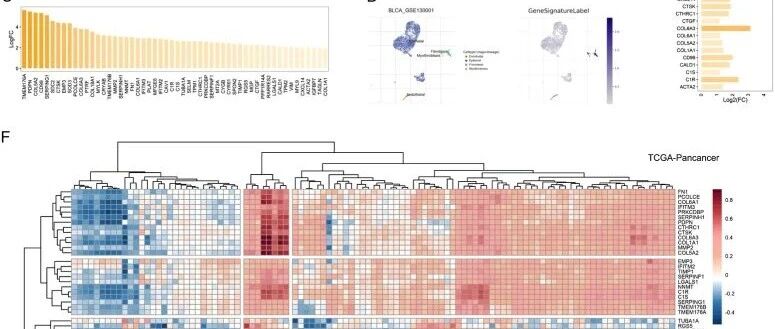
为探索膀胱癌肿瘤微环境(TME)中与分期相关的成分, 首先对膀胱癌的单细胞RNA测序数据集进行了聚类(图1A)。随后,通过SingleR R包对这些簇进行进一步注释(图1B)。 发现免疫细胞(如DC、单核细胞和巨噬细胞)、成纤维细胞和内皮细胞与膀胱癌T分期相关,即这些细胞的较高比例伴随着晚期阶段。大量研究指出成纤维细胞与肿瘤进展和免疫抑制之间存在密切关系,这促使 关注膀胱癌中这类细胞。通过先前设定的筛选阈值, 基于scRNA数据集GSE135337进一步鉴定了成纤维细胞相关基因(图1C,表S2,补充数字内容1)。
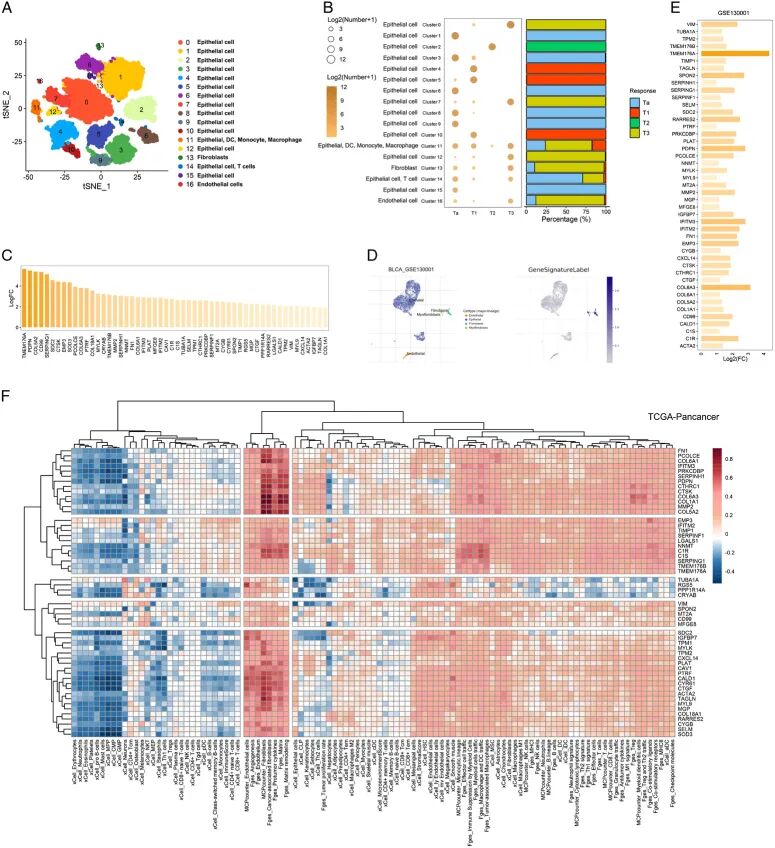
为验证这些基因, 将它们作为基因集提交到公共scRNA网站TISCH。这些基因mRNA表达的加权平均值被投射到另一个BLCA scRNA-seq数据集GSE130001上,结果显示这些基因在成纤维细胞簇中高度富集(图1D和E)。在泛癌症景观的其他scRNA-seq数据集中进行了相同的分析,显示出普遍相似的结果;即在TME中代表成纤维细胞的簇上观察到这些基因的高富集(图S1A和B,补充数字内容2)。有趣的是,差异表达FRG的一致率(即其他scRNA-seq数据集中差异表达FRG的数量/GSE135337中鉴定的54个FRG)在膀胱癌中最高,表明某些FRG在BLCA中特异性表达。当然,鉴定的FRG在几种其他癌症类型中也观察到表达上调,如BCC、BRCA、CHOL、CRC、STAD、SKCM和STAD,表明这些FRG特征可以扩展到其他癌症(图S1C,补充数字内容2)。
为确定这些基因是否在成纤维细胞中表达或与成纤维细胞高度相关, 进一步计算了这些基因与其他已识别特征(Fges、xCell、MCP counter)在TCGA-BLCA数据集和两个泛癌症队列(TCGA-Pan-cancer和GSE2109)中的相关性(图1F,图S2A和B,补充数字内容2)。大多数基因显示与成纤维细胞和其他基质来源特征呈高度正相关。有趣的是,这些基因与免疫相关细胞(如CD8+ T细胞、NKT和CD4+ Tcm)显示出低相关性或负相关性。这些结果进一步证明,这些基因可以作为膀胱癌甚至泛癌症中的成纤维细胞特征。
进一步的蛋白质-蛋白质相互作用(PPI)分析显示,这些基因彼此之间密切相互作用(图S2C,补充数字内容2)。FN1与其他基因具有最多的连接节点,表明FN1可能在成纤维细胞的这个特征中充当核心基因。共表达分析显示,大多数基因与其他基因高度相关,但CXCL14、PLAT和RGS5似乎与膀胱癌中的其他基因相关性较低(图S2D,补充数字内容2)。总而言之,这些鉴定的基因可以作为膀胱癌后续研究中的成纤维细胞特征。
膀胱癌中FRG的表观遗传学改变和机制
然后 进行了差异表达分析。结果显示,大多数基因在膀胱癌中表现出下调(图2A),而SERPINH1和CTHRC1在癌症中显示轻微上调。在膀胱癌组织中, 观察到这些基因主要在基质中表达,说明它们不是来源于肿瘤细胞(图2B和图S3,补充数字内容2)。从机制上讲,这些基因主要富集在局部粘附、血管平滑肌收缩、癌症中的蛋白聚糖、蛋白质消化和吸收相关通路,具有相同的蛋白质结合、细胞外基质结构成分、受体结合相关分子功能,位于细胞外区域(图2C,表S3,补充数字内容3)。此外,这些基因可能与几个生物学过程相关,如细胞粘附、对缺氧的反应和血管生成。
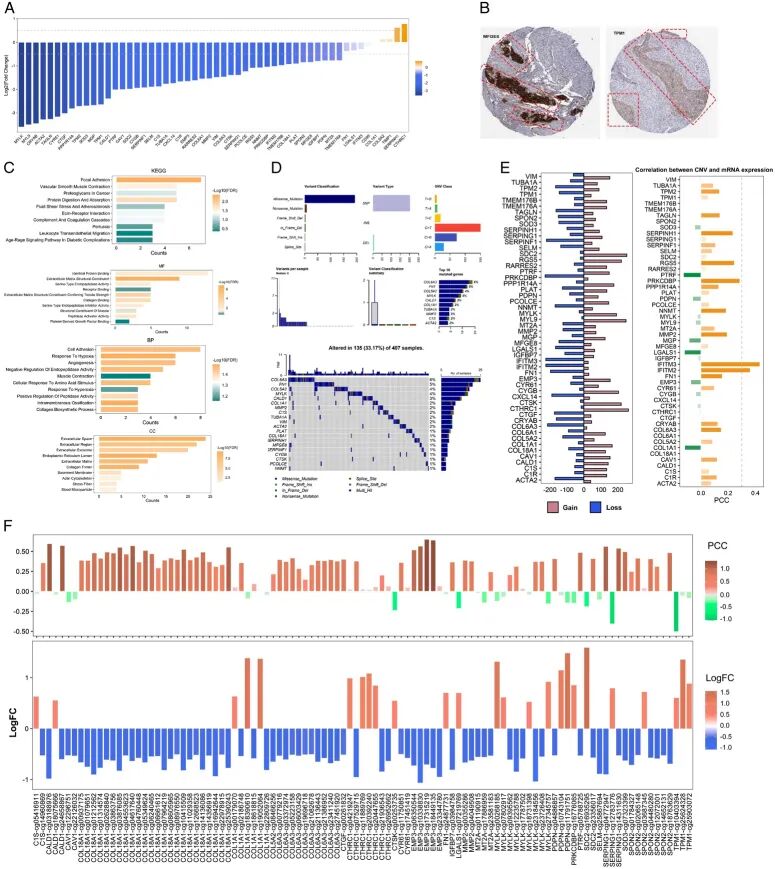
在突变图谱中,这些FRG的突变率较低,但COL6A3和FN1的突变率>5%但<10%(图2D),表明突变在这些基因表达中起微弱作用。然后 关注拷贝数变异(CNV)。FRG的CNV增益和缺失在膀胱癌中很常见。然而,只有IFITM3和IFITM2显示较高数量的CNV缺失,与其mRNA表达呈中度相关,表明这两个基因的表达可能在一定程度上受其CNV控制(图2E,图S4A,补充数字内容2)。
进一步分析了FRG的DNA甲基化,发现特定甲基化位点的几个基因的甲基化水平显示出差异表达(图2F)。有趣的是,大多数甲基化水平下调的位点与相应基因mRNA表达呈正相关。这些正相关位点主要位于基因体和岛区。然而,大多数甲基化水平上调的位点与相应基因mRNA表达呈负相关。负相关位点主要位于启动子区域,表明这些基因启动子上的甲基化改变抑制了基因mRNA表达(图2F和图S4B,补充数字内容2)。
FRG的重要性评估
然后 尝试各种方法来评估FGR的重要性和临床相关性。 发现根据其PubTator评分,44.4%(24/54)的基因被鉴定为研究不足的基因(评分<100),该评分代表与这些基因相关的发表数量(图3A,表S4,补充数字内容4)。然而,12.9%的基因PubTator评分超过1000,尤其是FN1显示最高评分,表明是研究最广泛的基因。
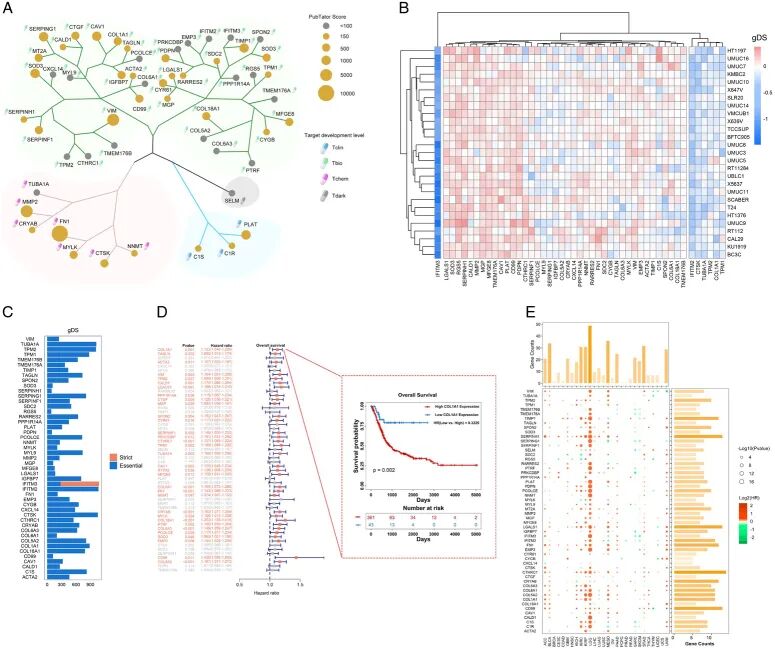
接下来, 关注基于靶点开发水平(TDLs)的FRG药物开发状态,该水平由NIH的Illuminating the Druggable Genome(IDG)项目评估。只有5.6%(3/54)的基因被鉴定为Tclin(被批准的药物靶向,包括CIS、CIR和PLAT),12.96%(7/54)的基因为Tchem(被满足活性阈值的小分子靶向,包括TUBA1A、NNMT、CRYAB、CTSK、MYLK、MMP2和FN1)。大多数基因(79.63%,43/54)被鉴定为Tbio,没有已知的批准药物和小分子活性。只有一个基因被称为Tdark(研究很少,不满足Tchem、Tclin和Tbio的标准)-SELM。这些组织的数据表明,仍需要更多研究来证明其功能和临床可操作潜力。
进一步观察了这些基因在膀胱癌细胞上的基因依赖性评分(gDS)。gDS用于通过测量给定基因缺失对单个肿瘤细胞活性的影响来估计基因的重要性。有趣的是, 发现在膀胱癌细胞中,只有几个基因,如IFTM3、IFTM2、CTSK、TUBA1A、TPM2、TPM1和COL1A1在大多数膀胱癌细胞中显示较低的gDS,表明这些基因,特别是IFTM3,可能在一定程度上影响细胞活性(图3B)。大多数基因在膀胱癌细胞中显示高gDS,只有几个基因在有限的细胞中显示较低的gDS。事实上,在代表不同系统的约1000个人类癌细胞中,除IFITM3外,大多数FRG仅在不到50%的细胞中显示必需(即gDS<0),IFITM3在超过50%的细胞中显示严格必需(即gDS<−1),没有其他基因在任何细胞中gDS<−1(图3C,图S5A和B,补充数字内容2),表明FRG在膀胱癌细胞中的高gDS评分不是一个特殊现象,而是大多数癌细胞中的普遍事件。然而,考虑到它们的功能和位置, 可以推测这些基因的缺失可能通过抑制成纤维细胞或其他基质功能来发挥抗肿瘤作用。膀胱癌细胞上gDS的结果似乎很清楚地表明FRG不是为靶向肿瘤细胞而设计的。
进一步探索了FRG与临床结果之间的相关性。在单变量Cox回归分析中, 发现大多数基因对膀胱癌患者的总生存期显示高风险(即HR>1且P值<0.05)(图3D)。即使一些基因与预后无关,患者不良结果也存在风险趋势。通过应用surv_cutpoint R函数,随后确定了每个预后相关FRG的理想截断值。然后,根据单个FRG的mRNA表达的理想截断值,将TCGA-BLCA分为两组,高表达组和低表达组。 观察到,与这些基因低表达的患者相比,高表达这些基因的患者显示出更差的临床结果(图3D和图S6,补充数字内容2)。
此外,热图显示大多数基因与膀胱癌的分期(94.44%的基因,51/54)和分级(88.89%的基因,48/54)相关,表明这些基因的高表达伴随着晚期阶段和分级,表明这些成纤维细胞来源的基因可能促进癌症进展(图S5C和D,补充数字内容2)。在泛癌症景观中进行了进一步验证,结果显示,超过50%的基因是BLCA、KIRC、KIRP、LGG、MESO、STAD和UVM中癌症患者预后的风险因素(图3E)。总而言之,这些成纤维细胞来源的基因被证明是膀胱癌患者预后甚至其他癌症类型患者的风险因素。
FRG风险特征和列线图构建
为确定与膀胱癌患者预后最相关的基因, 匹配了FRG的mRNA表达和总生存数据。然后, 基于十种机器学习类型进行了进一步筛选-Stepwise、Cox boost、Ridge、Enet、Lasso、RSF、plaRcox、GBM、Pamr和Boruta(图4A,表S5,补充数字内容5)。在重叠这些方法确定的基因后,最终验证了三个基因-CRYAB、FN1和COL6A1。然后,将三个基因提交进行多变量Cox回归分析。基于每个基因的系数和表达,最终计算出一个称为FRG指数(FRGI)的评分。
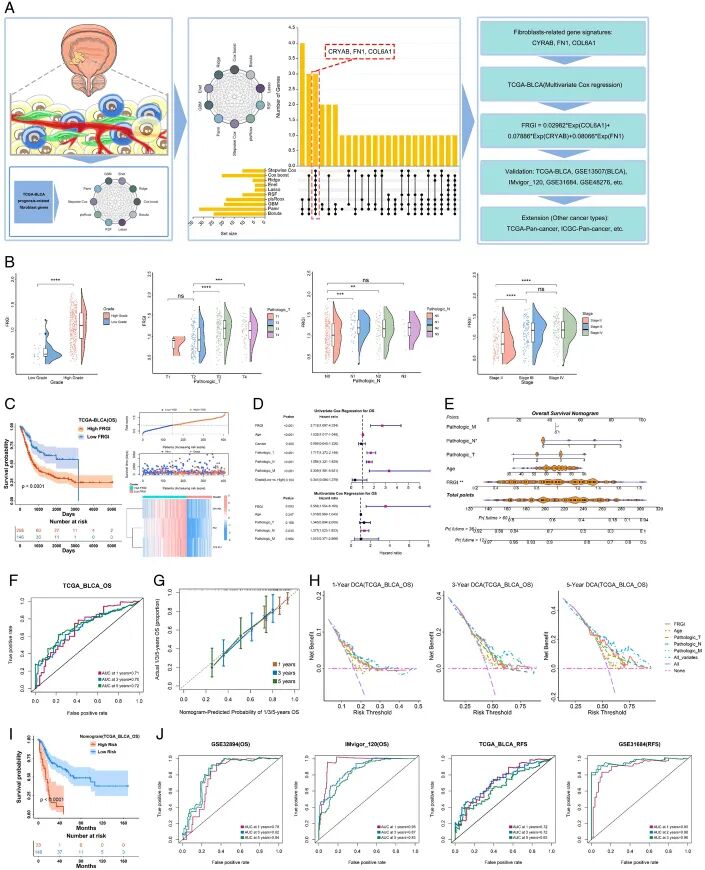
FRGI进一步用于预测预后,并通过其他膀胱癌和泛癌症数据集进行验证。在四个独立的BLCA数据集中,较高的FRGI通常与晚期阶段和分级相关,尽管相关性在单个数据集中并不总是显著的,但趋势是一致的(图4B,图S7A-E,补充数字内容6)。然而,FRGI与年龄和性别之间显示出弱相关性或无相关性。有趣的是,较高的FRGI通常与较差的化疗反应相匹配,表明具有成纤维细胞浸润和FRG表达的肿瘤可能抵抗化疗效果(图S7A,补充数字内容6)。
此外,在多个独立的BLCA数据集(TCGA-BLCA、GSE13507、GSE31684、IMvigor120、GSE32894和GSE48276)中,高FRGI组患者的总生存概率低于低FRGI组,高FRGI组死亡患者数量远多于低FRGI组(图4C,图S8A,补充数字内容6)。此外,高FRGI组患者的复发风险高于低FRGI组(图S8B,补充数字内容6)。当患者按不同临床亚组分离时(即在年龄方面,患者分为年龄>60和年龄≤60组),在独立数据集(GSE31684、GSE32894、IMvigor_120和TCGA-BLCA)中,高FRGI组仍然显示出比低FRGI组更差的结果,表明FRGI对膀胱癌患者的各种临床亚组实用且稳健(图S9,补充数字内容6)。
然后将FRGI和其他临床变量合并进行单变量Cox回归分析,并将显著的预后相关变量提交多变量Cox回归分析。结果证明,在TCGA-BLCA数据集中,经其他临床变量调整后,FRGI是独立的预后因素(图4D)。在GSE32894数据集中,FRGI在多变量Cox回归期间未显示显著性,但比其他变量更高的风险比表明FRGI在预测膀胱癌总生存期方面不能被忽视(图S10A,补充数字内容6)。在IMvigor_120数据集中,经治疗反应和转移调整后,FRGI显示为预后的独立因素(图S10B,补充数字内容6)。此外, 还观察了变量对膀胱癌无复发生存期的影响,结果显示FRGI在单变量Cox回归分析中对无复发生存期有风险影响,但在多变量Cox回归分析期间不是独立的风险因素(图S11A和B,补充数字内容6)。
进一步使用多变量Cox回归分析中的变量构建列线图,以预测膀胱癌的1/3/5年生存率(图4E)。时间依赖性ROC曲线和校准曲线显示,列线图在预测预后方面显示出高准确性(对于TCGA-BLCA OS:1年AUC=0.71,3年AUC=0.70,5年AUC=0.72;对于GSE32894 OS:1年AUC=0.78,3年AUC=0.82,5年AUC=0.84;对于IMvigor_120 OS:1年AUC=0.95,3年AUC=0.87,5年AUC=0.83;对于TCGA-BLCA RFS:1年AUC=0.72,3年AUC=0.72,5年AUC=0.65;对于GSE31684 RFS:1年AUC=0.90,3年AUC=0.96,5年AUC=0.96)。决策曲线分析显示,与每个单独变量相比,选择所有变量时临床获益最高。此外,基于列线图模型构建的风险评分在高/低风险组中显示出最大的生存概率差异(图4F-J,图S10A和B,补充数字内容6,图S11A和B,补充数字内容6)。
进一步在其他癌症类型中验证FRGI,结果与膀胱癌相似。即,高FRGI显示出比低FRGI更差的结果(图S12A和B,补充数字内容6)。这些结果表明,FRGI不仅可以预测膀胱癌的生存概率,还可以扩展到其他癌症类型。
成纤维细胞亚型确定
基于FRGI对膀胱癌预后的重要性, 通过基于FRG特征表达计算样本之间的欧几里得距离来生成成纤维细胞亚型。生成了成纤维细胞热型(FRG特征的高表达)和冷型(FRG特征的低表达)(图5A)。成纤维细胞亚型与肿瘤进展相关,显示晚期肿瘤阶段和分级主要位于成纤维细胞热型,成纤维细胞热型的结果比成纤维细胞冷型差(图5B)。这些结果在另外四个独立队列中得到进一步验证(图S13A-D,补充数字内容6)。
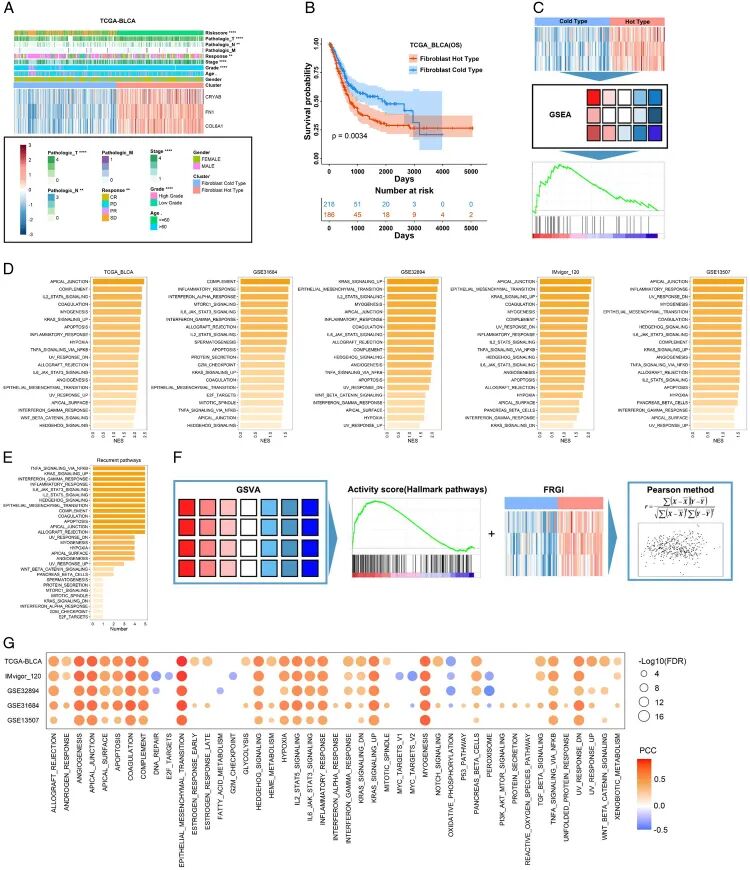
用成纤维细胞亚型替换FRGI进行后续机制分析。按成纤维细胞亚型排序的膀胱癌全基因组mRNA表达谱提交至基因集富集分析(GSEA)软件。然后,基于标志性癌症通路识别出不同的富集通路(图5C)。结果表明,多个癌症相关通路在成纤维细胞热型中高度富集,五个依赖数据集中的前20条通路如图所示(图5D)。其中,几条通路在成纤维细胞热型中普遍表现出高富集,主要包括TNFA SIGNALLING VIA NFKB、KRAS SIGNALLING UP、INTERFERON GAMMA RESPONSE、INFLAMMATORY RESPONSE、IL6 JAK STAT3 SIGNALLING、IL2 STAT5 SIGNALLING、HEDGEHOG SIGNALLING、EPITHELIAL MESENCHYMAL TRANSITION、COMPLEMENT等(图5E,表S6,补充数字内容7)。
为进一步验证, 计算了50条标志通路的活性评分,并根据Pearson方法进一步计算了标志通路与FRGI之间的相关性(图5F)。正如 所预期的,FRGI在五个BLCA数据集中与上述通路显示出高度正相关(图5G,表S7,补充数字内容8),表明这些成纤维细胞来源的基因可能激活这些通路以促进肿瘤预后或恶性表型。此外, 发现FRGI与几条通路呈负相关,如OXIDATIVE_PHOSPHORYLATION和PEROXISOME通路。总而言之,这些通路改变可能是癌症患者预后不良的潜在原因。
进一步对比了与膀胱癌相关的几种表型。 之前的研究表明,初级纤毛缺失导致膀胱癌细胞的恶性行为并促进SHH通路。在这项研究中, 还发现几个PC降解相关基因在成纤维细胞热型中显示出更高的表达,揭示成纤维细胞对肿瘤的侵袭可能与PC降解相关(图S14A,补充数字内容6)。当膀胱癌被分为不同的分子亚型时, 发现大部分基底型位于成纤维细胞热型、P53样亚型和富含基质型(图S14B,补充数字内容6,表S8,补充数字内容9)。此外,膀胱癌免疫亚型C2主要位于成纤维细胞热型,而C1和C4位于成纤维细胞冷型(图S14C,补充数字内容6)。
成纤维细胞类型与免疫治疗反应相关
越来越多的证据表明,成纤维细胞可以介导免疫细胞活性并抑制抗肿瘤免疫反应。如图1F所示,这些成纤维细胞来源的基因与免疫相关细胞显示出弱相关性或负相关性,这促使 进一步研究成纤维细胞是否影响免疫治疗效果。因此, 利用肿瘤免疫功能障碍和排斥(TIDE),一个集成了基于免疫检查点阻断(ICB)试验的大规模组学数据和生物标志物的公共网站,来预测对免疫治疗敏感或不敏感的潜在患者。根据TIDE评分,在TCGA-BLCA中识别出膀胱癌患者的应答者和无应答者(图6A)。
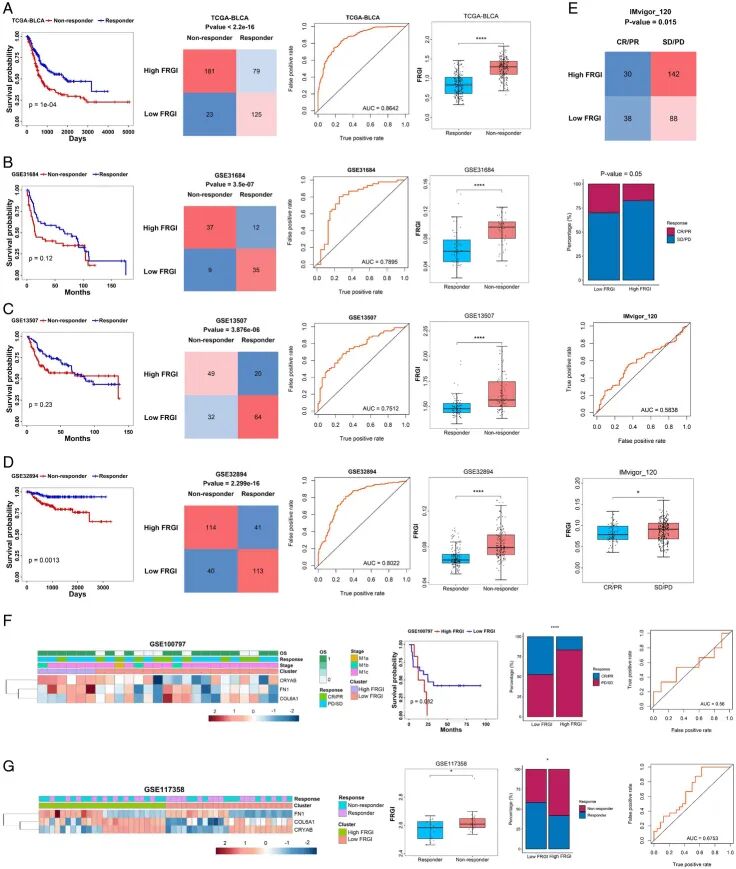
正如预期的那样,无应答者的结果比应答者差,表明免疫系统激活可以延长患者的生存率。此外, 发现无应答者主要分布在高FRGI组或成纤维细胞热型(P值<0.0001,χ²检验),表明成纤维细胞富集可能抑制免疫治疗效果(图6A和图S15A,补充数字内容10)。基于ROC的曲线下面积(AUC)显示,FRGI预测免疫治疗反应的准确性为0.8642,无应答者显示出更高的FRGI。 在另外三个独立的膀胱癌数据集(GSE31684、GSE13507和GSE32894)中进行了相同的分析,结果与TCGA-BLCA相似(图6B-D,图S15A,补充数字内容10)。
在转移性免疫治疗队列中, 还观察到稳定疾病和进展疾病的患者在高FRGI组中的比例高于低FRGI组(图6E)。尽管AUC较低(0.5838),SD/PD组的FRGI仍高于CR/PR组。 在代表黑色素瘤、非小细胞肺癌和胶质母细胞瘤的其他队列中生成FRGI;结果还显示高FRGI组的结果比低FRGI组差(图S15B-E,补充数字内容10,图S15G,补充数字内容10)。在代表黑色素瘤的免疫治疗队列中,高FRGI组显示出更差的预后和对免疫治疗的不良反应(对于GSE100797,AUC=0.56;对于GSE19293,AUC=0.5908)(图6F,图S15F,补充数字内容10)。
有趣的是,在患有间皮瘤和肾癌的小鼠队列中,无应答者显示出更高的FRGI,无应答者在高FRGI组中的比例更高,FRGI预测治疗反应的AUC为0.6753(图6G)。总而言之,这些结果表明,成纤维细胞亚型或FRGI不仅可以预测膀胱癌的免疫治疗反应,还可以在一定程度上评估其他癌症的效果。
CD8+ T细胞-成纤维细胞亚型构建、机制、表观遗传学改变
进一步探索了FRGI与膀胱癌免疫系统的关联。通过分析FRGI与75个免疫相关基因之间的相关性, 发现在五个膀胱癌数据集中,FRGI与大多数免疫相关基因呈正相关,包括几个免疫抑制分子,如PDL1(PDCD1)、PDL2(PDCD1LG2)、CD80、EDNRB、MICA和MICB。有趣的是,FRGI与VEGFB显示出高度正相关,但与VEGFA呈负相关;据报道,这两个基因起免疫抑制作用(图S16A,补充数字内容10)。此外,成纤维细胞热型显示出更高的免疫评分、基质评分和微环境评分(图S16B,补充数字内容10)。
对于免疫细胞的比例, 观察到B细胞记忆在成纤维细胞热型中没有显著改变或略有下降(图S16C,补充数字内容10)。CD8 T细胞的比例在这两种亚型之间在五个数据集中没有改变,而活化的NK细胞在除GSE32894外的大多数数据集中也没有变化。Tregs比例在IMvigor_120中略有增加,但在其他数据集中下降或无改变。总而言之,这五个数据集中免疫细胞的比例波动严重。
进一步探索了免疫细胞活性评分与FRGI或成纤维细胞亚型之间的关系。无论是成纤维细胞亚型还是FRGI, 发现在五个膀胱癌数据集中,免疫抑制细胞-Tregs和M2巨噬细胞在成纤维细胞热型和高FRGI组中高度活化(图7A和B,图S17A和B,补充数字内容10)。然而,抗肿瘤免疫细胞-CD4+ T细胞、CD8+ T细胞和NKT的活性在成纤维细胞亚型和高/低FRGI组中没有显示出显著差异。FRGI与Tregs、M1和M2巨噬细胞活性呈正相关,但与CD4+ T细胞、CD8+ T细胞和NKT没有相关性或呈负相关(图7C和图S17C,补充数字内容10)。这似乎表明成纤维细胞可以激活Tregs和M2巨噬细胞来抑制免疫系统。

然而,据说抗肿瘤免疫反应不仅与一个因素相关,考虑到抗肿瘤免疫细胞与免疫治疗效果密切相关,利用单一FRG特征来估计肿瘤患者对免疫治疗是敏感还是抵抗显然是片面的。因此, 尝试将FRG特征与抗肿瘤免疫结合进行进一步研究。在五个独立的膀胱癌数据集中, 基于三种抗肿瘤免疫细胞的活性-CD4+ T细胞、CD8+ T细胞和NKT进行了生存分析。 发现CD8+ T细胞在每个数据集中的结果相似;即,高CD8+ T细胞活性显示出比低活性更好的预后,而其他两种细胞在五个数据集中不稳定(图S18A,补充数字内容10),表明CD8+ T细胞有资格与成纤维细胞结合构建新的稳定亚型。
据报道,CD4和CD8 T细胞浸润增长的肿瘤被证明是免疫炎症性肿瘤,也称为热肿瘤,被称为免疫反应性。然而,CD8+ T细胞足以作为分类免疫学冷热肿瘤的信号。这些结果支持 将CD8+ T细胞与 构建的FRG特征结合起来。通过理想的截断值,确定了高/低CD8+ T细胞活性并与成纤维细胞亚型结合,随后构建了CD8+ T细胞-成纤维细胞亚型,包括高CD8+ T细胞活性成纤维细胞热型(CD8+FH)、高CD8+ T细胞活性成纤维细胞冷型(CD8+FC)、低CD8+ T细胞活性成纤维细胞热型(CD8-FH)、低CD8+ T细胞活性成纤维细胞冷型(CD8-FC)。
在TCGA-BLCA数据集中,CD8+FC型患者显示出最佳预后,CD8-FH型患者代表最差预后(图7D)。此外,在GSE31684、IMvigor_120和GSE32894中观察到相同的结果,除了GSE13507数据集(图S17D,补充数字内容10)。有趣的是,在相同的CD8+ T细胞活性组中,成纤维细胞热型总是显示出更差的预后。在代表不同癌症类型的其他数据集中, 也观察到类似的结果(图S18B,补充数字内容10)。此外,当 使用FRGI和CD8+ T细胞活性预测免疫治疗反应时, 发现与单独使用FRGI相比,准确性显著提高(图S19A,补充数字内容10)。
发现大多数CD8+FC型患者倾向于对免疫治疗有反应,而只有一小部分CD8-FH患者对免疫治疗反应敏感(图S19B和C,补充数字内容10)。另一个免疫治疗数据集进一步验证了这一点,即CD8+FC组患者似乎有更多百分比的完全反应和部分反应(图S19D,补充数字内容10)。 进一步使用GSE91061数据集,该数据集包含58个治疗中(ICB治疗期间)和51个治疗前(ICB治疗前)的黑色素瘤和NSCLC RNA测序数据,以分析亚型迁移的动态进展。 发现,具有低FRGI和高CD8+ T细胞活性的患者在治疗中数据中显示出最高的反应率(图S19E,补充数字内容10)。
更重要的是,在匹配同一患者的治疗中和治疗前数据后, 发现CD8+Low FRGI、CD8+High FRGI和CD8-High FRGI组没有迁移到其他类型。然而,在CR/PR队列中,CD8-Low FRGI组的一小部分患者迁移到CD8+High FRGI和CD8+Low FRGI组。在SD/PD队列中,治疗前CD8-High FRGI组的患者迁移到除CD8+Low FRGI组外的其他类型。CD8+Low FRGI组的患者可能迁移到具有恶性表型的其他三种类型(即高FRGI、低CD8+ T细胞活性或两者都有),表明SD/PD队列发生了复杂的动态迁移进展,FRGI结合CD8+ T细胞可以描绘迁移并解释导致免疫治疗不敏感的原因(图S19E,补充数字内容10)。
进一步基于基因集分析(GSA)分析了这四种类型的潜在机制,并鉴定了基因特征,在TCGA-BLCA数据集中不同的基因特征在不同类型中高度或低度富集;另外三个数据集进行了进一步验证(图7E,图S20A,补充数字内容10)。例如,T细胞在CD8+FC和CD8+FH型中显著富集;EMT通路在CD8-FH型中高度富集,JAK_STAT3和IL2_STAT5信号通路主要富集在CD8+FH型中。代表癌症相关通路、免疫检查点和抗原呈递系统的其他特征被进一步分析,并揭示了四种类型的不同活性或表达(图7F)。
然后 使用TCGA外显子组数据来识别类特异性突变和拷贝数畸变(CNAs)(图7G,图S20B和C,补充数字内容10)。集中关注突变率>10%的基因。TP53、MUC16和KDM6A在四种亚型中显示出普遍高的突变率(均>10%),特别是在CD8+FC型中(图S20B,补充数字内容10)。RB1突变主要富集在除CD8+FC型外的三种亚型中。CD8+FH型携带KMT2A和AHNAK的更频繁突变,而CD8+FC型的特征是DST(20%)和LRP1B(20%)的突变富集。对于其他临床可操作基因,FGFR3(16%)突变主要富集在CD8+FC型中(图7G)。ATR在CD8+FH和CD8+FC型中分别显示出更高的突变率(11%和10%)。EPHA3在CD8+FH型中显示出最高的突变频率。
对于拷贝数,通过GISTIC 2.0软件确定跨类型的畸变。CD8-FC型富集CCND1、DDR2、MCL1、NOTCH2、EGFR、MYC、CDH1、VHL、CCNE1、XPO1等的扩增。CD8-FC型富集CCND1、MCL1、ERBB2、CCNE1、FGFR3等的扩增。在CD8+FH型中,富集DDR2、EGFR、CCND1、CCND3、CCNE1、FLT3、ASXL1等的扩增。而在CD8+FC型中,携带CCND1、MCL1、FGFR3、CCNE1、MYC、MDM2、ERBB2、AKT3等的扩增。这些跨亚型的CNAs为基于特定类型开发靶向药物提供了潜力(图S20C,补充数字内容10,表S9,补充数字内容11)。
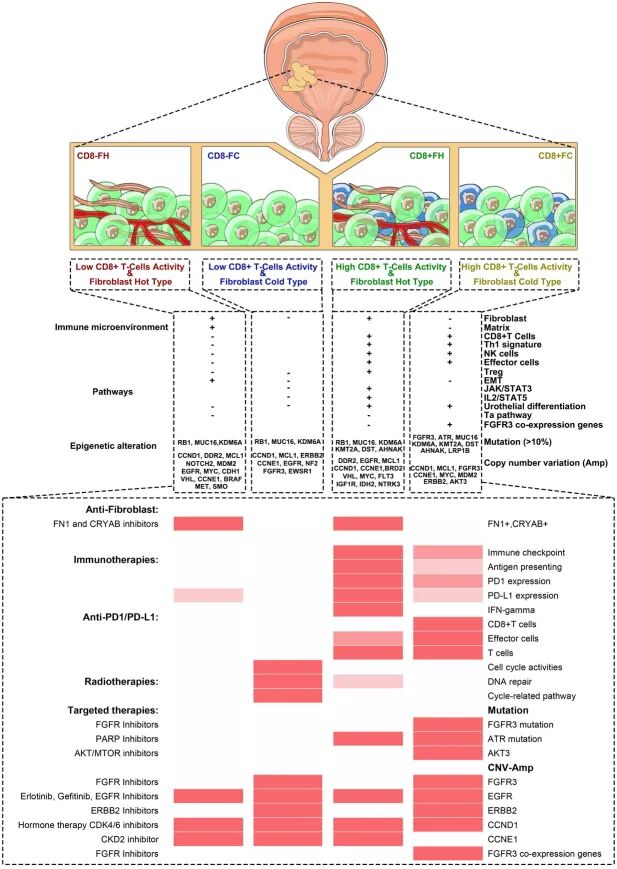
总而言之, 基于三个成纤维细胞来源的基因和CD8+ T细胞活性构建了四种亚型,以预测膀胱癌的预后和免疫治疗反应(图7H)。 基于多组学特征合并了每种类型的所有信息,并生成了潜在的治疗图谱,这可能为基于膀胱癌亚型的联合治疗策略提供基本策略(图8)。
欢迎各位 对文章思路感兴趣的老师同学联系🌹 ⬇️
感谢点赞 👍、转发 📤、关注 ⭐